«Des phages tuent les bactéries causant la dysenterie et réduisent la virulence des bactéries survivantes», source ASM News.
Les phages sont des virus qui infectent les bactéries et peuvent également être utilisés pour traiter les infections humaines. Cependant, comme avec les antibiotiques, les bactéries peuvent facilement développer une résistance à l'attaque des phages, mettant en évidence une limitation clé à l'utilisation des phages comme thérapeutique.
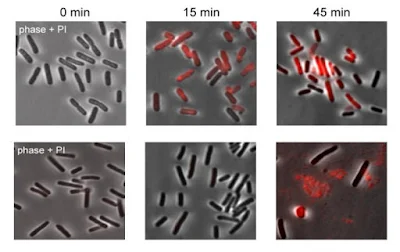
Désormais, des chercheurs de l'Université de Yale ont montré que le phage A1-1 d'origine naturelle tue Shigella flexneri, une cause majeure de dysenterie en Afrique subsaharienne et en Asie du Sud et sélectionne des mutants résistants aux phages avec une virulence réduite. L’étude est publiée dans Applied and Environmental Microbiology, Selection for phage resistance reduces virulence of Shigella flexneri.
Cette découverte fortuite résulte du fait que l'utilisation par le phage d'un récepteur de surface particulier sur la bactérie appelé OmpA, comme portail pour entrer et tuer S. flexneri, signifie que les bactéries qui échappent à l'attaque du phage seront soit dépourvues de récepteurs OmpA, soit que tout les récepteurs restants auront muté de manière à réduire la virulence.
«Nous avons cherché à découvrir un phage naturellement capable de se lier aux protéines de la membrane externe de S. flexneri responsables de la propagation virulente de cellule à cellule de ce pathogène dans l'intestin humain, en supposant que l'évolution de la résistance aux phages devrait modifier, ou éliminer, cette virulence facteur de protéine», a déclaré Kaitlyn E. Kortright, chercheuse en postdoc à Yale.
Ceci, a déclaré Kortright, est «un compromis évolutif utile sur le plan biomédical qui améliore les approches de phagothérapie standard.»
Les chercheurs ont poursuivi la phagothérapie contre S. flexneri parce que cette bactérie était déjà résistante aux antibiotiques conventionnels. De plus, ce pathogène est actif principalement dans les pays à faible revenu, où les antibiotiques sont chers et souvent indisponibles, et où l'eau potable est rare. Les phages, a-t-elle expliqué, «pourraient même être utiles pour traiter les sources d'eau, en sélectionnant des S. flexneri avirulents.»
Les chercheurs ont commencé ce projet sans savoir s'il existait ou non un phage capable de tuer S. flexneri. Ils ont supposé «que ces virus avaient naturellement évolué et pouvaient être isolés à partir d'échantillons environnementaux», a déclaré Paul E. Turner, professeur d'écologie et de biologie évolutive à Yale.
Pour augmenter les chances, «nous avons choisi de chercher dans une région géographique réputée pour son extrême biodiversité microbienne, Cuatro Cienegas, Mexique. Clairement c’était pas gagné, mais apparemment c’était une idée raisonnable, car cet effort a été couronné de succès.»