Les transformateurs et les fabricants d'aliments
ont pour mission de fournir des aliments de qualité et sûrs aux
consommateurs.
Le cheminement pour réussir dans cette mission,
cependant, est différent pour chaque entreprise. Chaque ingrédient,
processus de fabrication, installation et produit fini présente des
défis uniques en matière de sécurité alimentaire et les bonnes
pratiques de fabrication actuelles (cGMPs
pour current good manufacturing practices) pour les relever.
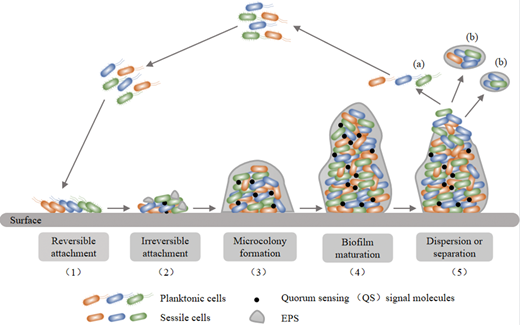
Cependant, il existe un ennemi commun qui prospère
dans la plupart des usines de fabrication d'aliments. Les biofilms
sont une masse naturelle de
pathogènes protégés par une substance polymérique extracellulaire
(EPS), qui se fixe aux surfaces et résiste aux tentatives de
désinfection.
Signes d'avertissement de la présence de
biofilms
Lorsque les inspecteurs de la FDA
ou d'organisations tierces parties certifiées visitent des
installations alimentaires, ils ne recherchent pas spécifiquement de
biofilm, qui est invisible à l'œil nu. Les inspecteurs sont formés
pour reconnaître les conditions qui indiqueraient la présence d'un
biofilm, comme les résidus alimentaires sur l'équipement et
d'autres surfaces, ainsi que les siphons
de sol, car ils sont connus pour héberger
des biofilms.
«Nous examinons
si les programmes de
nettoyage-désinfection sont
efficaces, y compris si l'entreprise effectue des essais
pour des micro-organismes indicateurs où
des nombres élevés pourraient indiquer un nettoyage-désinfection
inadéquat et éventuellement des biofilms», selon une
porte-parole de la FDA. «Nous prenons souvent nos propres
écouvillons si nous constatons des conditions douteuses.»
Si les échantillons présentent un nombre élevé
de
pathogènes après nettoyage-désinfection,
il est probable qu'ils soient protégés par un biofilm et non par
des micro-organismes flottant librement. Les zones où l'eau ne
s'écoule
pas sont un autre signal
d’alerte, a-t-elle dit.
Il est essentiel que les plans de sécurité des
alimentaire préviennent
les conditions qui favorisent l'établissement et la croissance de
biofilms.
«Établissez et mettez en œuvre de cGMPs
et des programmes de contrôle de nettoyage-désinfection,
envisagez une évaluation de la nettoyabilité de l'équipement lors
de l'analyse des dangers
et développez des programmes de nettoyage qui préviennent
la formation de biofilms», a dit
la porte-parole de la FDA.
Méthodes de maîtrise
du biofilm
Si un biofilm est présent dans une usine de
transformation des aliments, il existe plusieurs façons d'attaquer
les EPS et les pathogènes. Bob Forner, directeur du marketing pour
Hunt Valley, a dit
que les méthodes ont des degrés de succès variables. Sterilex
fabrique des produits de contrôle microbien qui attaquent non
seulement les agents pathogènes du biofilm, mais également la
structure de
l’EPS. Si la structure protectrice
reste intacte, les pathogènes peuvent repeupler le biofilm en deux
jours, a déclaré Forner.
Les principaux moyens de réagir au biofilm dans
une installation alimentaire sont les suivants:
nettoyer à la main : un savon/détergent peut
aider à décomposer l’EPS, et l'huile de coude permet de soulever
la structure de la surface. Cela demande beaucoup de main-d'œuvre et
certaines zones sont difficiles d'accès pour le récurage à la
main, a déclaré Forner. Bien que le boîtier de protection soit
attaqué avec un lavage à la main, un désinfectant enregistré par
l' Environmental Protection Agency (EPA) est nécessaire pour
détruire
les micro-organismes logés dans la structure.
chaleur: Un traitement de type autoclave,
chauffant une surface à au moins 129,5°C,
est efficace. Cela nécessite une utilisation importante d'énergie,
et de nombreux matériaux et équipements dans une installation
alimentaire ne peuvent pas être chauffés à la température
nécessaire, a dit
Forner. (Pensez aussi à autoclaver les pièces démontables d’un
siphon de sol -aa)
oxydation chimique: Les nettoyants
et désinfectants oxydants se divisent en deux catégories, selon
Sterilex. Les oxydants réactifs avec l'EPS tels que l'eau de Javel,
l'iode et l'ozone sont plus agressifs pour l'équipement et ne
pénètrent pas complètement la structure du biofilm, et les
oxydants pénétrant dans l'EPS traversent les couches de biofilm
pour tuer les pathogènes. Ils sont incapables de tuer à la fois
l'EPS et les pathogènes, a-t-il dit.
agents sur
les biofilms: la technologie PerQuat de
Sterilex est approuvée par l'EPA pour tuer les organismes du biofilm
et éliminer le biofilm des surfaces. La chimie brevetée combine un
oxydant, le peroxyde d'hydrogène, et un catalyseur de transfert de
phase, l'ammonium quaternaire, pour pénétrer le biofilm et libérer
le peroxyde pour tuer les organismes à l'intérieur.
Maintenance/Prévention: bien que la Loi sur la
modernisation de la sécurité des aliments
promulguée il y a plus de 10 ans, ne traite pas des biofilms, les
règlements sont conçus pour se concentrer sur la prévention des
conditions qui pourraient conduire à des épidémies de maladies
d'origine alimentaire causées par des pathogènes qu'ils
contiennent.
«La FSMA (ou Food Safety Modernization
Act) se concentre sur le contrôle des dangers et des biofilms
pouvant contenir des pathogènes seraient traités par des contrôles
préventifs du
nettoyage-désinfection qui sont
requis dans de nombreux plans de sécurité des aliments,
ainsi que les cGMPs», a dit
la porte-parole de la FDA.
Une combinaison de ces étapes est le moyen le
plus efficace de lutter contre les biofilms dans une installation
alimentaire, a dit
Forner.
«Les programmes de lavage des mains et
de
maintenace font partie de presque
tous les plans principaux de
nettoyage-désinfection de la
transformation des aliments», a dit
Forner. «Combiner ces méthodes avec la chimie appropriée
enregistrée par l'EPA est un moyen puissant de mettre
les biofilms hors de l'installation de
transformation des aliments.»
NB: L’image est
extraite du site de l’Institut Pasteur, Fighting
biofilms.